arcadion a écrit:Comme mes arguments - basés sur la physique - n'arrivent pas à te convaincre
Pardon? Je n'ai lu aucun argument basé sur la physique.
Tu affirmes au contraire des choses qui contredisent toutes les publications depuis une bonne centaine d'années.
Je suis tres contrarié de voir que des affirmations non fondées vont semer la panique (ou au moins la confusion) chez ceux qui n'ont pas pris le temps de s'interresser a ces questions.Les metaux possedent une bande de conduction, certains electrons de leurs orbitales exterieures sont libres et voyagent d'atome en atome.
Ces electrons peuvent donc se deplacer le long d'un metal, par exemple un fil metalique.
C'est ainsi qu'ils conduisent le courant (d'electrons).
Cette situation ne se rencontre pas dans l'eau, ou les electrons de l'hydrogene sont engagés dans des liaisons covalentes.
Je te propose d'ouvrir un "Paul Arnaud", cours de chimie physique qui traite tres bien de la question.
Pour t'en convaincre de facon pratique, une experience d'electrolyse realisé avec de l'eau distillée (donc pure), ne donne rien. Aucun courant ne passe.
En revanche si tu reunis deux conditions:
- presence d'un sel par exemple (meme en faible quantité)
- application d'une tension exterieure capable de realiser l'oxydo-reduction en fournissant une energie au moins egale a celle correspondant au ions en presence.
Alors oui tu realises ton electrolyse.
Des ions se forment a une des electrodes, et cedent ou reprennent des electrons a l'autre. Il y a alors un courant (d'ions). Mais il faut que les potentiels a ces electrodes possedent les bonnes valeurs pour assurer ces transformations.
arcadion a écrit:je vais me rabattre sur du bon sens paysan et des exemples.
Les électron ne se déplacent pas dans l'eau : tu expliqueras ca aux fans de Claude François, ils seront ravis.
Je pense que Claude Francois utilisait pour ses ampoules des tensions de l'ordre de plusieurs centaines de volts qui n'existent pas entre les pieces du moteur et du bocal.
arcadion a écrit:Mais plus sérieusement Cyril, je te pose la question suivante :
à quoi servent donc les anodes qu'utilisent les propriétaires de bateaux ?!?J'ai tapé 'anode bateau' sur google pour trouver des schémas et des explications "extérieures" et voilà le premier lien que j'ai trouvé, je pense que les explications te convaincront mieux que les miennes :
Je cite : "
Deux métaux de potentiels électriques différents, placés dans de l'eau, créent un courant. Le métal de faible potentiel (l'anode) se dégrade au profit de l'autre, appelé cathode."
C'est un phénomène pourtant connu de corrosion entre hélice et coque... je suis vraiment étonné de rencontrer autant de réticences.
Le lien pour les sceptiques :
http://www.anodes-carenage-corrosion.com/fonderie__1_qui-sommes-nous_1.htmlChris.
Ce lien est celui d'un fabricant d'anodes sacrificielles et non un cours d'electro-chimie.
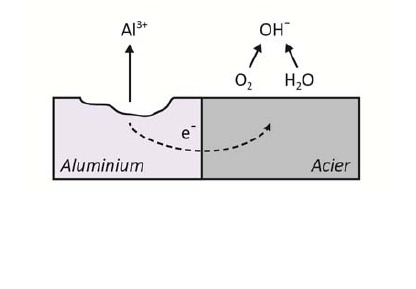
Dans le cas d'un navire a coque acier et a helice en bronze il y a couplage electrique entre tous les elements.
L'acier est perdant, et cela oxyde la coque.
On dispose donc des petites masses de zinc ou de magnesium sur la coque, a l'exterieur.
Ces metaux dans l'echelle sont perdants par rapport a l'acier, les phenomenes qui se produisent attaquent ces anodes mais pas la coque.
Il faut remplacer de temps en temps les anodes oxydees.
Dans le cas d'un bateau d'ailleurs le probleme est plus complexe.
L'eau a la ligne flotaison est plus oxygenee que celle plus profonde qui baigne la quille, il apparait un couple galvanique acier/acier.
Ces phenomenes sont bien connus.